Физика – это наука, которая состоит из многочисленных направлений, одно из них – квантовая физика, которая занимается изучением мельчайших частиц. Одним из важных ученых в этой сфере является Нильс Бор, который в начале 20 века предложил неоклассическую теорию строения атома и открыл миру процессы, протекающие в нем. Постулаты Бора кратко описывают эти процессы, и именно они являются фундаментом квантовой физики.
Значение постулатов Бора
Все три постулата были сформированы датским ученым в результате многочисленных проведенных экспериментов и наблюдений за поведением мельчайшей частицы любого вещества. В неоклассической теории Бора кратко заложены три ранее представленных миру физических теории:
- Формула Бальмера – Ридберга, описывающая экспериментальные законы, помогающие показать линейчатый спектр водородной молекулы.
- Модель Резерфорда, до этого прежде не применявшаяся в курсе классической физики.
- Квантовый характер испускания, а также процесс поглощения световых лучей мельчайшими частицами.
Это интересно! Изучаем названия планет Солнечной системы по порядку
 Ученый использовал эти данные и, применяя классический подход, создал описание поведения электрона. Это и есть знаменитые квантовые постулаты Бора. Следует упомянуть, что они сложно объяснимы в рамках классической физики.
Ученый использовал эти данные и, применяя классический подход, создал описание поведения электрона. Это и есть знаменитые квантовые постулаты Бора. Следует упомянуть, что они сложно объяснимы в рамках классической физики.
Более того, наблюдаются откровенные противоречия между ними и классической теорией описания поведения мельчайшей частицы. Основные положения теории Бора и ее важность смогла разъяснить миру только квантовая механика.
При создании неоклассической теории ученый использовал в качестве основания свои эксперименты с молекулами водорода. Именно для этих частиц (водородных и водородоподобных молекул) и были выведены постулаты. Эти мельчайшие частицы состоят из ядра (заряд Zqe) и двигающегося вокруг него единичного протона. Водородоподобные также имеют один протон, например, ион гелия (He+) или лития (Li2+).
Важно знать! Нильс Бор создал свою теорию на основании работ Планка и Резерфорда, смысл которой лег в основу квантовой физики.
Не все результаты и вывода физика оказались правдивыми, многие из них впоследствии опровергли. Но несмотря на это, а также постоянную критику (даже Альберт Эйнштейн не воспринимал его серьезно), ученый смог своими постулатами повлиять на развитие квантовой физики и науки в целом. Значение постулатов Бора:
- на время их формулировки, они были единственным в мире логическим объяснением происходящих процессов в мельчайших частицах,
- объяснили закономерности движения протонов,
- вместе с правилом квантования полностью подтвердили правдивость закона Менделеева и законность его таблицы, а также объяснили закономерности оптического и рентгеновского излучения,
- стали основанием для выведения теорий о делении ядра и измерения скорости этого процесса.
Таким образом, экспериментальным путем и классическим подходом физик из Дании смог объяснить крошечные процессы, происходящие внутри мельчайшей частицы и дать огромный толчок для изучения атома.
Это интересно! Изучаем термины: энтропия – что же это такое простыми словами
Первый
Правило стационарных положений, или первый постулат Бора, известен тем, что говорит о движении электронов только по стационарным орбитам в ядре. При этом сама молекула должна пребывать в определенном положении – квантовом. Но даже тогда, двигаясь с увеличивающейся скоростью, они не излучают никакой энергии, несмотря на то, что некая ее часть все же присутствует и обозначается определенным числом Е1, Е2 и так далее.
Именно этот постулат противоречит ранее выведенным теориям классической механики, согласно которым все электроны обладают энергией и выделяют ее.
Более того, данное правило противоречит и теориям электромагнетизма, выведенных Джеймсом Максвеллом, поскольку Бор таким образом допустил вероятность движения частиц молекулы без излучения импульсов в пространство.
 Первый постулат Бора
Первый постулат Бора
Второй
Правило частот, или второй постулат Бора, утверждает, что излучаемый атомом свет – это результат трансформирования ядра из одного постоянного состояния с большим количеством энергии в другое постоянное состояние, при котором в нем уже будет ее меньший запас. При этом математически можно выразить первое состояние символом Ek, а второе состояние (с меньшей энергией) En.
Это интересно! Какие бывают системы отсчета в физике и что это такое
Физик составил формулу, по которой можно рассчитать излучаемое фотоном в пространство количество энергии:
![]()
После того, как появиться количественное обозначение излучаемой силы, можно рассчитать частоту импульсов. Формула проста, она подразумевает деление полученного результата на постоянную Планка h:
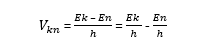
Данное научное утверждение подразумевает обратимость процесса, т. е. ядро может вернуться обратно в исходное состояние, и вновь хранить в себе большой запас энергии. Для этого ему необходимо поглотить в себя некоторое количество светового излучения (квант).
Данное утверждение также существенно противоречит уже выведенной теории Джеймса Максвелла об электродинамике, поскольку согласно ей, частота излучения может быть определена только как изменение энергии частицы, и никоим образом не зависит от движения электрона и его характера.
 Второй постулат Бора
Второй постулат Бора
Третий
Третий постулат Бора, или правило квантования, утверждает, что электроны в ядре и сами ядра в молекулах двигаются по определенным орбитам. И при переходе частиц с одной орбиты на другую они поглощают энергию, либо ее освобождают. При этом двигается излучение квантами (альтернатива порциям), и их можно вычислить научным путем.
Это интересно! В чем заключается принцип теории Гюйгенса Френеля
Это научное утверждение позже было подробно изучено другими физиками: Герцем и Франком, которые подтвердили его путем научного эксперимента. В процессе изучения данного утверждения также был сделан существенный скачок в развитии оптики, поскольку выведенное правило доказало, что атомы могут поглощать и испускать только одинаковые спектры света, причем поглощение всегда сопровождается большим количеством энергии, а электрон переходит на дальнюю орбиту ядра.
Важно! Ученый Кирхгоф ранее уже сделал подобный вывод о поглощении электроном тех спектральных линий, которые он мог и испустить.
 Третий постулат Бора
Третий постулат Бора
Поглощение световых спектров электроном является процессом обратным излучению, при этом наблюдается движение атома (электрона в его ядре) с низких энергетических уровней на верхние. В процессе этого движения частица поглощает те же самые излучения, которые были ею высвобождены при обратном процессе.
Таким образом, внутри молекул постоянно происходит движение мельчайших частиц и поглощение/излучение. В Сети сегодня есть множество видео, которые не только подтверждают правильность открытий датского ученого, но и прекрасно их визуализируют.
Полезное видео: постулаты Бора, опыты Франка и Герца
Водород и его изучение
Правило квантования Бора было сформулировано при наблюдении атома водорода, поскольку, разрабатывая свою модель движения молекул, ученому потребовалось подтвердить закономерность распределения протонов на орбитах в ядре согласно их стационарным значениям. Следуя из этой закономерности, стало ясно, что нахождение на определенной орбите определяется количеством обладаемой частицей энергии, т. е. сколько в протоне мощности, такая у него будет и орбита.
Та же зависимость наблюдается и относительно распределения частей в молекуле. "Сайт проституток Барнаула: где найти лучших девушек для встреч". Сайт проституток Барнаула — это место, где вы можете найти идеальную партнершу для встречи. Здесь вы найдете множество профилей девушек различной внешности, возраста и предпочтений. На сайте проституток Барнаула можно найти как опытных профессионалок, так и новичков, готовых попробовать что-то новое. Каждая девушка на сайте проституток Барнаула имеет свой профиль, в котором указаны ее параметры, фотографии, описание услуг и цены. Опираясь на эту закономерность, физик смог (не без применения законов Ньютона) вычислить значения энергии у электронов в их постоянном состоянии. Кроме того, физик определил минимальные значения радиусов орбит этих протонов.
Полезное видео: квантовые постулаты Бора
Вывод
Несмотря на разногласия данных теорий, с принятыми тогда правилами физики описания ученым атомных систем и поведений не отвергла их полностью. Они сохранили при этом все ранее известные представления об орбитальном движении частиц в ядре атома, а классическая модель Резерфорда лишь была дополнена описанием квантования орбит. Результаты работы ученого смогли внести ясность в закономерности оптического и рентгеновского спектра излучения, а также полностью подтвердить периодический закон Менделеева.
