…
Теплота и температура
Перед тем как изучить закон Гесса и рассмотреть следствия, вытекающие из него, вспомним, что такое термохимия, чем она занимается и какие ставит перед собой задачи. Рассмотрим понятие теплообмена, теплоты и энергии в химическом смысле.
Выделение тепла происходит сплошь и рядом. Активность движения молекул является единственной и основной причиной всех термодинамических явлений. Процесс диффузии, эффузии, явление теплопроводности – все это легко объясняется молекулярной теорией строения вещества.
Численная характеристика, которая описывает тепловой вид энергии, называется температурой. Нагревать тело теоретически можно сколь угодно долго, оно будет менять свое агрегатное состояние. Смене состояния всегда сопутствует тепловой эффект химической реакции.
Важно! Тело во время нагрева и охлаждения меняет свое агрегатное состояние, только если остальные параметры (давление и объем) сохраняются. Практически, меняя объем и уровень давления, при нагреве можно избежать перехода.
Охлаждать тело (т.е. отдавать его тепло) бесконечно долго не выйдет, так как существует некий предел, когда все молекулы полностью замирают, и из тела выходит все тепло. Такой предел носит название абсолютного нуля. Температурой абсолютного нуля является минус 273 градуса по шкале Цельсия.
Говоря о Цельсии, следует отметить, что существует три наиболее популярные шкалы измерения температур:
- шкала Цельсия,
- шкала Фаренгейта,
- шкала Кельвина.
Шкала Цельсия привязана к поведению воды при нормальных условиях (атмосферном давлении). Согласно этой шкале вода замерзает при температуре 0 градусов по Цельсию, а кипит при температуре 100 градусов. Эта шкала стала очень удобной в бытовой и повседневной жизни: комнатная температура около 25 0С, температура тела 36,6 0С. Шкала Фаренгейта привязана к раствору воды, соли и нашатырного спирта. Температура замерзания этого раствора составляет 0 0F, что приблизительно равно -17,8 0С.
Шкала Кельвина носит наибольший физический смысл. Нулем по этой шкале принято считать абсолютный ноль, т.е. -273 0С. Эта шкала лишена отрицательных температур и имеет прямую линейную связь с остальными. Вода кипит при 373 0К, замерзает при 273 0К.
 Измерение температуры
Измерение температуры
Что такое термохимия?
Нагревание и охлаждение – несимметричные физические понятия, физическим смыслом обладает только понятие нагревание (повышение температуры). Процесс охлаждения возможен только при передаче тепловой энергии. Тело, которое отдает тепло, становится холоднее. В результате этого принято говорить, что оно охлаждается. Для сравнения можно использовать понятие свет и тьма. Если свет является физическим явлением, возможным при существовании соответствующих элементарных частиц, то тьма – это всего лишь отсутствие света.
После того как термопередача завершена, температуры обоих тел сравниваются и наступает равновесие. Во время термообмена проистекает трата тепловой энергии, которая называется теплотой. Эта величина измерима в Джоулях (или калориях) и представляет собой энергию той же природы, что и в механике (представленная в виде работы сил).
Существует устойчивый миф (особенно он часто показан в кино), что в космосе все тела быстро замерзают и покрываются снегом и инеем. Однако следует помнить, что космос представляет собой почти что вакуум. Поэтому отдавать тепло тела не могут в космосе, так как отсутствует вещество, проводящее тепло. Говоря простыми словами, тепловой энергии некуда деться. По этой причине уже более 5 миллиардов лет горячая магма земли сохраняет свою температуру почти постоянной.
 Если химия начинает изучать физические законы строения материи, акцентируя особое внимание на разновидности процессов, изучить которые можно только при помощи химической теории, то такой раздел химии носит название физическая химия.
Если химия начинает изучать физические законы строения материи, акцентируя особое внимание на разновидности процессов, изучить которые можно только при помощи химической теории, то такой раздел химии носит название физическая химия.
Область физ. химии, которая исследует структуру вещества в явлениях с сопровождением выделения или обмена теплоты, с превращениями внутренней энергии растворов в тепло, носит название химическая термодинамика.
Если данный раздел естествознания будет акцентировать особое внимание на исследовании явлений с выделением тепла, которые протекают во время процессов, то его принято называть термохимия. Термохимия представляет собой область знания, изучающую преобразования термического типа, процессы, в которых выделяются и поглощаются тепловые виды энергий.
Закон Гесса
Этот закон заслуженно считают главным законом термохимии. Формулировка закона Гесса закона выглядит так:
Численные значения тепловых эффектов, во время протекания химических реакций не зависят от того каким образом протекают сами процессы.
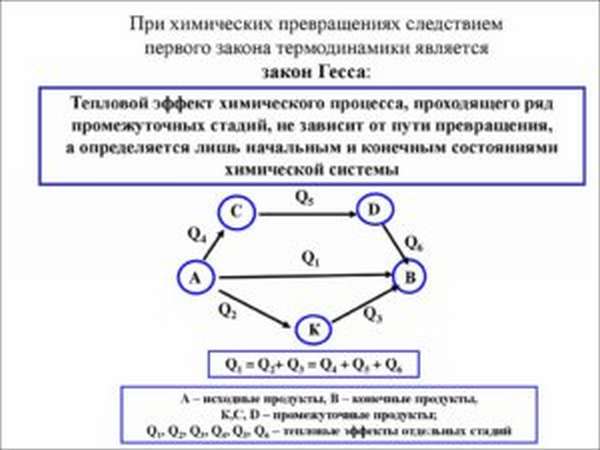 Основной закон термохимии гласит, что если есть множество различных способов провести одну и ту же химическую реакцию, то тепловые процессы будут одинаковы во всех случаях.
Основной закон термохимии гласит, что если есть множество различных способов провести одну и ту же химическую реакцию, то тепловые процессы будут одинаковы во всех случаях.
Естественно, это будет так, если условия всех реакций одинаковы – давление, температура равны. Это научное утверждение, несмотря на интуитивную очевидность, далеко не так просто понять. Давайте разберем его формулировку.
Если процесс проходит в абсолютно идентичных условиях, т.е. либо давление, либо температура неизменны, то независимо от того во сколько стадий будет проходить реакция, тепловая энергия (вырабатываемая или затраченная) будет неизменна.
Важно! Один из самых простых примеров закона: усваивание сахаров в человеческом теле. Переработка глюкозного раствора в нашем теле происходит по очень сложным органическим реакциям, разбитым на множество органических этапов. Однако энергия, выделяемая в течение всего растворения, так или иначе, такая же, как энергия простого сгорания глюкозы.
Постараемся выразить закон Гесса в математической форме. Для этого представим себе, некоторую реакцию между веществами А1, А2, А3 и т.д. Это могут любые вещества –вода, углекислый газ, кислоты, щелочи и т.д. Сама реакция также может быть любой – окисление, восстановление, дегидратация и пр. Наша задача при помощи ряда веществ А1, А2 и т.д. получить вещества В1, В2 и т.д. Например, реакция окисления, в которой окислителем является ион водорода:
![]() .
.
В этой реакции исходные вещества: железо и соляная кислота являются примерами наших гипотетических А1, А2, а конечными веществами являются хлорид железа и водород – пример В1, В2.
Естественно, это не единственная реакция при помощи которой можно получить![]() и водород. Например, можно, получить
и водород. Например, можно, получить ![]() при помощи меди:
при помощи меди:
![]() .
.
Таким образом, можно утверждать, что есть множество различных способов из веществ А1, А2 получать вещества В1, В2. При этом во время реакций будет выделятся определенное количество теплоты, которое мы будем обозначать![]() .
.
Например, если реакция проходит простым традиционным путем в один шаг, то выделяется теплота![]() . Если можно провести реакцию другим путем (тоже в один шаг), то получается уже другое количество теплоты
. Если можно провести реакцию другим путем (тоже в один шаг), то получается уже другое количество теплоты ![]() , если, к примеру, реакция проходит в два этапа, то сначала выделяется теплота
, если, к примеру, реакция проходит в два этапа, то сначала выделяется теплота ![]() , а потом
, а потом ![]() , но в сумме получается
, но в сумме получается ![]() .
.
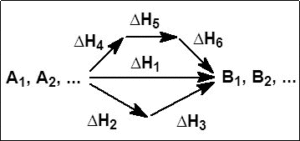
Учитывая эти обозначения, в математическом виде закон Гесса представить довольно легко. Если в результате реакции выделяется энергия но разными путями выделялись тепловые эффекты ![]() ,
, ![]() ,
, ![]() , при этом эта же реакция может протекать еще двумя путями с выделением эффектов
, при этом эта же реакция может протекать еще двумя путями с выделением эффектов ![]() ,
, ![]() , то формула закона Гесса будет выглядеть так:
, то формула закона Гесса будет выглядеть так:
![]() .
.
Благодаря этому термохимическому утверждению есть возможность численно извлекать и рассчитывать энергию термодинамических явлений, которую экспериментальными способами получать крайне сложно и энергозатратно. Иными словами, зная численной значение внутренней энергии в уже проверенной реакции, является возможным вычислить тепловой эффект в более сложном процессе.
Следствия закона Гесса
Рассмотрим два следствия из закона термохимии.
 Энтальпией называется энергия, которая доступна в теоретическом, потенциальном виде для преобразования в тепло в изобарном процессе. Напомним, что изобарным процессом называется процесс, протекающий при постоянном давлении.
Энтальпией называется энергия, которая доступна в теоретическом, потенциальном виде для преобразования в тепло в изобарном процессе. Напомним, что изобарным процессом называется процесс, протекающий при постоянном давлении.
Приставка -изо означает постоянство. Так, изохорический и изотермический процессы означают постоянную температуру и объем соответственно
Пример привести очень легко. Если есть баллон, в котором под прессом находится газ, то энтальпией является сумма потенциальной энергии пресса (mgh, где m – масса пресса, h – высота, на которую он поднят) и собственной энергии газа. Простыми словами, энтальпия – это та энергия, которая могла бы выделиться и непременно выделится, если процессу дать ход.
Например, вы сидите под яблоней. Прямо над вашей головой висит яблоко. Теоретически, оно может упасть. Если вы будете продолжать сидеть под яблоней, то так или иначе оно упадет и ударит. Энтальпия в данном случае это потенциальная энергия яблока. Энтальпию будем обозначать через ![]() . Если речь об энтальпии продуктов химической реакции (левой части формулы), то будем отмечать ее
. Если речь об энтальпии продуктов химической реакции (левой части формулы), то будем отмечать ее ![]() . Если же речь будет идти об энтальпии реагентов (правой части), то отметим ее
. Если же речь будет идти об энтальпии реагентов (правой части), то отметим ее ![]() . Буквой n будем отмечать количество вещества, иными словами это коэффициент, который принято ставить в химической реакции перед веществом. Например:
. Буквой n будем отмечать количество вещества, иными словами это коэффициент, который принято ставить в химической реакции перед веществом. Например:
![]() ,
,
число n – это цифра 2 перед соляной кислотой.
Первое следствие
Тепловой эффект химической реакции представляет собой сумму всех энтальпий продуктов данной реакции, за исключением сумм всех энтальпий исходных веществ.
В виде формулы, записать данное следствие легко:
![]() .
.
Этот закон позволяет рассчитать тепловой эффект реакции наиболее простым способом.
Второе следствие
Данное утверждение, являющийся следствием закона Гесса применимо только к соединениям органического типа.
Сформулируем второе следствие. Тепловые эффекты химических реакций, в которых принимают участие органические вещества, представляет собой сумму энергии сгорания изначального вещества, за исключением энергии сгорания продуктов реакции.
Важно! Говоря о тепловом сгорании, имеется в виду теплота полного сгорания, например углерод С должен окислиться до углекислоты ![]() , водород окисляется до воды
, водород окисляется до воды ![]() .
.  Второе следствие закона Гесса
Второе следствие закона Гесса
Примеры решения задач
Перейдем к рассмотрению двух наглядных примеров, при помощи которых мы научимся искать тепловые эффекты химических реакций. Если у вас появилось желание насладиться разнообразным сексом, вас точно привлекут популярные шлюхи Ставрополя . Вы можете выбирать шлюх по внушительному ряду особенностей, включая их габариты, объем груди, а также район!
Пример 1. Необходимо посчитать энергию сгорания этилового спирта, используя исключительно табличные данные.
Решение:
Окисление этилового спирта (расставим все коэффициенты):
![]() .
.
Воспользуемся уравнением (закон Гесса):
![]() ,
,
![]() ,
,
![]() кДж/моль.
кДж/моль.
Пример 2. Определите тепловой эффект дегидратации этилового спирта, зная:
![]() ,
,
![]() ,
,
![]()
(благодаря результатам предыдущей задачи).
Решение.
Реакция дегидратации:
![]()
Воспользуемся 2 следствием закона Гесса:
![]() 188 кДж/моль.
188 кДж/моль.
Несложно убедиться, что основной закон термохимии действительно является основным, ведь на нем и его следствиях базируется вся современная экспериментальная химия.
Закон Гесса и изменение энтальпии реакции
Задача Закон Гесса
Вывод
Серия правил и утверждений, с которыми мы познакомились в данной статье, являются базовыми во всех научных сферах. Он ежедневно используется в биохимии, микробиологии, генетике и фармацевтике, ведь в этих науках очень важно уметь рассчитывать тепловой эффект реакции.
