Существует область в физической химии, которая занимается анализом скорости химических процессов, определением условий, воздействующих на увеличение или снижение скорости. Это направление называется химическая кинетика. Данная область науки изучает механизмы проведения и термодинамические особенности процессов. Полученные знания используются в научных целях, при производстве химических веществ, когда важно контролировать взаимодействие ингредиентов в реакторах.
Терминология
 Под термином «скорость реакции» подразумевают эквивалентное изменение концентраций ингредиентов, участвующих в реакции, за обозначенную временную единицу. Для расчетов скорости предназначена специальная формула: ᴠ = ±C/t.
Под термином «скорость реакции» подразумевают эквивалентное изменение концентраций ингредиентов, участвующих в реакции, за обозначенную временную единицу. Для расчетов скорости предназначена специальная формула: ᴠ = ±C/t.
Единица измерения скорости – моль/л*с при проведении гомогенного процесса, когда реагирует весь объем. Для многостадийной реакции, когда есть четко обозначенные фазы, применяют другую единицу измерения – моль/м2*с.
Разноскоростные химические процессы
Химические компоненты могут взаимодействовать между собой с разной скоростью. К примеру, сталактиты формируются в результате нарастания карбоната кальция. Скорость роста образования – полмиллиметра за 100 лет. Так же медленно проходят другие биохимические реакции. Довольно низкой скоростью отличаются процессы синтеза белка и коррозия металлов.
 Быстрее проходят другие процессы, для завершения которых требуется один или несколько часов. К таким реакциям относится приготовление пищи, когда происходит разложение и преобразование соединений, имеющихся в продуктах питания.
Быстрее проходят другие процессы, для завершения которых требуется один или несколько часов. К таким реакциям относится приготовление пищи, когда происходит разложение и преобразование соединений, имеющихся в продуктах питания.
На протяжении определенного промежутка времени следует нагревать реакционный состав, который используется для синтеза некоторых полимеров.
К быстрым химическим реакциям следует отнести нейтрализацию, контактирование разбавленной уксусной кислоты с обычной пищевой содой, в результате чего выделяется углекислый газ. В перечень можно добавить реакцию натриевых солей с нитратом бария, по завершении которой в осадок выпадает нерастворимый сульфат бария.
Важно! Существует огромное количество химических процессов, которые протекают очень быстро и завершаются взрывом. Яркий пример – соединение калия и воды.
Факторы, влияющие на скорость реакции
 Соединяя химические вещества, получают реакцию, которая в разных условиях протекает с различной скоростью. К примеру, при комбинации водорода и кислорода в газовом состоянии смесь долгое время находится в бездействии, но если емкость встряхнуть либо ударить, то реакция закончится взрывом.
Соединяя химические вещества, получают реакцию, которая в разных условиях протекает с различной скоростью. К примеру, при комбинации водорода и кислорода в газовом состоянии смесь долгое время находится в бездействии, но если емкость встряхнуть либо ударить, то реакция закончится взрывом.
В связи с такими особенностями специалисты химической кинетики выделили ряд факторов, имеющих способность повлиять на быстроту прохождения химической реакции.
Среди таких условий различают:
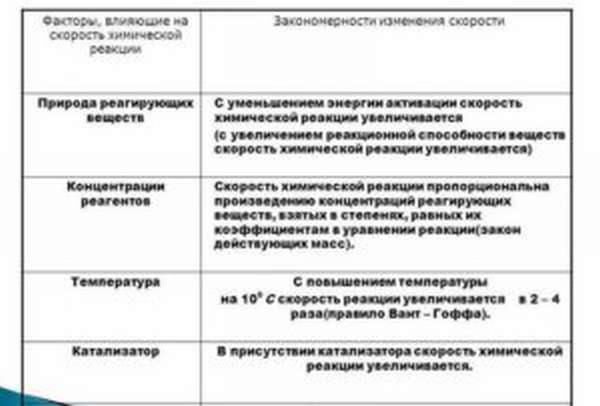
- природные свойства реагирующих компонентов,
- концентрация реагентов,
- температурные перепады,
- применение катализатора,
- скачки давления (при использовании газообразных компонентов),
- площадь взаимодействия веществ.
Природные свойства реагентов
 Большая разница в скоростях химреакций обусловлена разными коэффициентами энергии активации – лишнего объема энергии, количество которого превышает средние значения, необходимые частицам для соударения и осуществления взаимодействия. Параметр имеет свою единицу измерения кДж/моль. Эти значения варьируются от 50 до 250.
Большая разница в скоростях химреакций обусловлена разными коэффициентами энергии активации – лишнего объема энергии, количество которого превышает средние значения, необходимые частицам для соударения и осуществления взаимодействия. Параметр имеет свою единицу измерения кДж/моль. Эти значения варьируются от 50 до 250.
При избытке энергии в количестве 150 кДж/моль в нормальных условиях реакция не протекает. Объем выделенной энергии израсходуется на предотвращение отталкивания молекул, минимизацию связей внутри вещества. От активационной энергии зависит прочность химсвязей в ингредиентах. Значение энергии отображает активность реакции:
- менее 40 – взаимодействие проходит быстро, все удары молекул заканчиваются реакцией,
- больше 40, но меньше 120 – средняя скорость, только половина столкновений являются эффективными,
- более 120 – медленное взаимодействие, поскольку незначительная часть соударений частиц заканчивается реакцией.
Концентрация веществ
 Количество молекул в единице объема воздействует на быстроту взаимодействия. Процесс подпадает под закон действующих масс. Закон применяется для простейших реакций, проходящих за одну стадию. Также подходит для многоэтапных реакций, когда процесс происходит на конкретной стадии.
Количество молекул в единице объема воздействует на быстроту взаимодействия. Процесс подпадает под закон действующих масс. Закон применяется для простейших реакций, проходящих за одну стадию. Также подходит для многоэтапных реакций, когда процесс происходит на конкретной стадии.
Скорость химпроцесса с учетом условия закона определяется формулой V=k·[A]a·[B]b. В математическом уравнении a и b выступают в роли стехиометрических коэффициентов, [A] и [B] – это концентрации реагентов, k является константой скорости.
Значение скорости отображает идентичный коэффициент, если концентрации реагирующих ингредиентов равны единице. Для корректных расчетов с использованием формулы нужно брать во внимание агрегатное состояние компонентов. Концентрация твердого ингредиента равна единице, поэтому в уравнение не входит, так как во время реакции она не меняется.
Для определения коэффициента скорости в формулу включают исключительно компоненты жидкого и газообразного состояния.
Температурный режим
 Течение химреакции зависит также от температурных условий. Опытным путем выявлено, что активность некоторых химических процессов увеличивается в несколько раз, если температуру поднять минимум на 10 градусов. Следующие 10 градусов также провоцируют увеличение активности в 2–4 раза.
Течение химреакции зависит также от температурных условий. Опытным путем выявлено, что активность некоторых химических процессов увеличивается в несколько раз, если температуру поднять минимум на 10 градусов. Следующие 10 градусов также провоцируют увеличение активности в 2–4 раза.
К сожалению, не изучен механизм воздействия температуры на быстроту отдельно взятой реакции. Также не определен перечень закономерностей. Можно предположить с точки зрения логики, что рост температуры способствует усилению хаотического движения молекул и атомов, в результате чего количество их столкновений значительно возрастает.
Однако от этой особенности воздействия не увеличивается эффективность соударения частиц, ведь главным катализатором этого процесса является энергия активации. Также для эффективности взаимодействия молекул необходимо их пространственное соответствие.
Применение катализаторов
 Активность реакции в химии изучает также и другое направление, которое называется катализ. Его задача – выяснить, как и по какому алгоритму небольшие объемы обозначенных веществ увеличивают скорость отзыва реагентов. Такими веществами называют катализаторы. Причем сам катализатор, ускоряя реакцию, практически не расходуется.
Активность реакции в химии изучает также и другое направление, которое называется катализ. Его задача – выяснить, как и по какому алгоритму небольшие объемы обозначенных веществ увеличивают скорость отзыва реагентов. Такими веществами называют катализаторы. Причем сам катализатор, ускоряя реакцию, практически не расходуется.
Ускорители способны изменить механизм химического процесса и спровоцировать образование таких переходных состояний вещества, которые имеют более низкий энергетический барьер. Катализатор может сократить энергию активации, увеличить число результативных столкновений молекул. Если взаимодействие энергетически невозможно, то использование ускорителя бессмысленно.
Площадь контакта компонентов
 При смешивании веществ, пребывающих в разных агрегатных состояниях, либо компонентов, которые не способны соединиться в гомогенную смесь, на скорость химреакции в значительной мере влияет площадь взаимодействия ингредиентов.
При смешивании веществ, пребывающих в разных агрегатных состояниях, либо компонентов, которые не способны соединиться в гомогенную смесь, на скорость химреакции в значительной мере влияет площадь взаимодействия ингредиентов.
Это обусловлено протеканием гетерогенной реакции на границе контактирования реагентов. То есть чем шире эта граница, тем большее количество частиц сталкивается и провоцирует быструю реакцию.
Яркие примеры подобных свойств:
- мелкие щепки горят намного активнее, чем целые бревна,
- в жидкости лучше растворяются измельченные твердые вещества, чем целый кусок.
Важно! При измельчении твердого ингредиента происходит произвольное разрушение кристаллической решетки реагента, поэтому реакционные свойства частиц увеличиваются.
Влияние давления
 Перепады давления во время реакции могут повлиять на активность, только когда в качестве реагентов применяются газообразные вещества. Высокое давление способствует увеличению количества молекул компонента в единице объема, плотность реагента возрастает. При низком давлении количество частиц уменьшается, следовательно, концентрация снижается.
Перепады давления во время реакции могут повлиять на активность, только когда в качестве реагентов применяются газообразные вещества. Высокое давление способствует увеличению количества молекул компонента в единице объема, плотность реагента возрастает. При низком давлении количество частиц уменьшается, следовательно, концентрация снижается.
Скорость химического взаимодействия – это количество и эффективность столкновения молекул реагентов. Этот процесс может происходить быстрее или медленнее, если создать соответствующие условия. На возрастание скорости могут влиять факторы, которые можно в разной степени регулировать:
- температурный режим,
- уровень концентрации реагирующих компонентов,
- увеличение или уменьшение давления,
- преобразование разнородных компонентов в одинаковое агрегатное состояние.
Полезное видео
Подведем итоги
В значительной мере быстрота реагирования веществ зависит от стартовой энергии и геометрических особенностей молекул. Данные два параметра контролировать и корректировать невозможно. Изучение ответных реакций химкомпонентов на воздействие перечисленных факторов имеет большую ценность для многих отраслей промышленности. Данные используются при проведении лабораторных исследований, в фармакологической сфере, металлургии, кулинарии, на атомных предприятиях, при производстве лакокрасочной продукции, полимеров.
