Химия – это довольно сложная наука, и разобраться в ней удается далеко не всем. А все потому, что для того чтобы ее выучить, надо обязательно понять базовые определения. И начинать разбираться в этой науке надо с самых основ. Давайте рассмотрим основные понятия и законы химии, которые стоит знать каждому.
…
Что изучает химия?
Самый главный вопрос, который волнует химиков, – это превращения веществ, которые сопровождаются различными изменениями. Но тут следует заметить, что не все превращения являются предметом внимания химии, а лишь те, при которых основное вещество меняет свой состав и строение.
Это приводит к вопросу: а из чего же состоят вещества? Любые вещества в природе – это прежде всего несколько молекул, соединенных между собой. А молекулы – это в свою очередь несколько атомов с образованными между ними химическими связями. Но до того как разбираться с устройством химической связи, надо рассмотреть строение одного атома.
Строение атома
Даже атом не является мельчайшей частицей, составляющей вещество, хотя довольно длительное время считалось именно так. На самом деле он состоит из ядра, в котором находятся положительные частицы – протоны и нейтральные – нейтроны. Вокруг этого ядра по особым осям движутся отрицательные частицы – электроны. А суммарный заряд всегда равен нулю, потому что количество протонов и электронов одинаково.
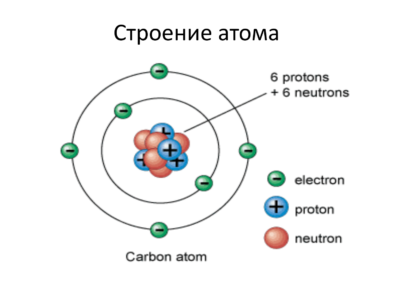
Исторически так сложилось, что из-за несовершенства оборудования ученые сначала предполагали, что атомы – это мельчайшие частицы, и они цельные (от этого и произошло название, с греческого оно переводится как неделимый). А уже после того, как в ходе многочисленных опытов было доказано, что все же существуют какие-то более мелкие частицы, длительное время ученые из разных стран пытались определить, как именно они взаимно располагаются.
Было предложено очень много идей, и для современной науки многие из них смешны, но тем не менее на их основе в свое время Бор вывел постулаты о движении электронов в атоме. Благодаря его открытию множество явлений в химии, объяснения которым ранее не было, стали понятны. В частности, наконец выяснилось, что такое частица в том понимании, которое распространено сегодня. Оказалось, что в любом атоме есть несколько энергетических уровней, на каждом из которых существуют орбитали, по которым и движется электрон.
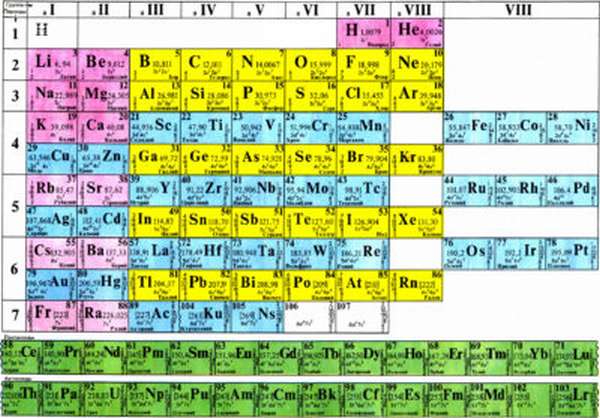
Периодический закон и таблица Д.И. Менделеева
Но еще раньше русский ученый Дмитрий Иванович Менделеев, не имея представления о том, как именно устроены мельчайшие частицы, смог ввести их классификацию. Она называется периодическим законом, а отображен он в периодической таблице. В ней находятся все открытые на данный момент элементы, и ежегодно эта таблица только растет.
Так в чем же заслуга Дмитрия Ивановича? В его таблице каждому химическому элементу отведена своя ячейка и присвоен номер. Этот номер показывает количество электронов и протонов внутри атома. Как Менделеев смог это предвидеть, до сих пор является тайной. Но более того, все элементы распределены еще и в свои группы и периоды. И период, например, показывает сколько именно в атоме заполненных энергетических уровней. А номер группы указывает на то, сколько электронов находится на последнем энергетическом уровне.
Кроме того, благодаря этой таблице стало достаточно легко разделить все химические элементы на две больших группы – металлы и неметаллы.
Основное их различие в том, что металлы находятся в начале каждого периода, и у них мало электронов на последнем энергетическом уровне, поэтому при образовании химической связи они стараются отдать свои электроны. Об этом подробнее будет рассказано ниже, когда речь пойдет о химической связи. А у неметаллов, наоборот, на последнем энергетическом уровне много электронов, и находятся они в конце таблицы. И при образовании связи они стремятся принять электроны.
 Также в таблице указана масса каждого атома – это атомная масса. Она измеряется в единицах атомной массы, это сделано для удобства в вычислениях, потому что реальная масса одного атома слишком мала для того, чтобы ее использовать. Поэтому было решено принять за единицу массу одного атома водорода.
Также в таблице указана масса каждого атома – это атомная масса. Она измеряется в единицах атомной массы, это сделано для удобства в вычислениях, потому что реальная масса одного атома слишком мала для того, чтобы ее использовать. Поэтому было решено принять за единицу массу одного атома водорода.
Складывая атомные массы всех химических элементов, входящих в состав химического соединения, можно получить молекулярную массу – массу одной молекулы. Вот ответ на вопрос, как найти массу вещества. Эти значения используются при проведении различных расчетов. Все эти возможности сделали закон и таблицу незаменимыми помощниками для химиков всех стран.
Внимание! В России используют классическую таблицу, в том виде, в котором она была создана изначально, там выделяется малый период. А за рубежом ее немного переделали и сделали длиннопериодной. С появлением этой концепции все остальные потеряли свой смысл.
В таблице Дмитрия Ивановича находятся самые распространенные в природе элементы, но у большинства из них есть еще и изотопы. Что такое изотопы? Это атомы, которые имеют такой же заряд, но отличаются по массе. Это объясняется тем, что количество нейтронов внутри ядра может быть различным. Например, только атомов водорода в природе находится три разных вида – протий, дейтерий и тритий. Они применяются в промышленности, например, в ядерных реакторах.
Химическая связь
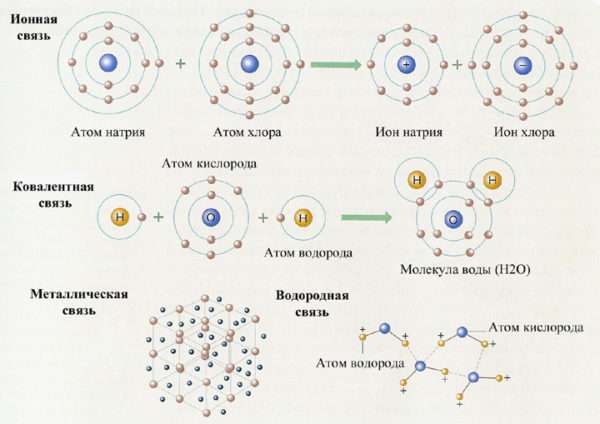
Теперь вернемся к химической связи. Следует отметить, что химическая связь всегда осуществляется только за счет электронов, ядро там не принимает участия. Как уже говорилось выше, на последнем энергетическом уровне находятся разное количество электронов. Но у любого атома есть “желание” сделать так, чтобы этот уровень был завершен. И если электронов на последнем уровне немного, то он старается их отдать, а если, наоборот, много, то старается забрать электроны у другого элемента, чтобы закончить уровень. Существует несколько основных типов связи:
- Ковалентная неполярная – это связь между двумя и более, но при этом совершенно одинаковыми атомами. Они объединяют свои электроны, и эта общая пара или несколько пар находятся ровно посередине между ними. По такому типу, например, образуются молекулы кислорода, водорода, азота.
- Ковалентная полярная – также осуществляется за счет объединения электронов в общую пару. Но образуется она уже между разными химическими элементами. И в этом случае общая пара сдвинута к тому, у которого электроотрицательность больше. Так образуется большое количество молекул, например, оксиды углерода, хлорид фосфора и другие. Как правило, ковалентная связь образуется между неметаллами.
- Ионная связь – это связь, при которой электроны от одного атома полностью переходят к другому. Наблюдаться это может только тогда, когда разница в электроотрицательностях очень большая. Поэтому образование такой связи возможно только между металлами и неметаллами. По такому типу связи образован всем известный хлорид натрия.
- Есть связь между двумя металлами – металлическая. Она совершенно не похожа на другие. По ней между собой соединено большое количество металлов, а между ними в свободном пространстве находятся свободные электроны. Они свободно двигаются по всему пространству и могут взаимодействовать с любым атомом.
- И особый тип связи – это водородная связь. Она образовывается достаточно сложно, и объяснить механизм ее возникновения непросто. Она может образовываться как между молекулами, так и внутри одной молекулы. При этом связывается водород и элемент с большой электроотрицательностью, в роли которого может выступать азот, кислород или фтор. Такой тип связи обуславливает спиралевидную форму белковых молекул или, например, особые свойства воды.
 Химическая связь Важно! Состав молекулы и связи внутри нее отражаются в ее формуле.Что такое химическая формула? Они бывают двух видов. Молекулярная формула показывает лишь состав молекулы. А с помощью графической можно увидеть не только какие атомы входят в состав молекулы, но и как они соединяются между собой.
Химическая связь Важно! Состав молекулы и связи внутри нее отражаются в ее формуле.Что такое химическая формула? Они бывают двух видов. Молекулярная формула показывает лишь состав молекулы. А с помощью графической можно увидеть не только какие атомы входят в состав молекулы, но и как они соединяются между собой.
Вот пример графической формулы по химии. Цифра три рядом с водородом – это индекс, который показывает, что с одним углеродом непосредственно связано три атома водорода.
Химические соединения
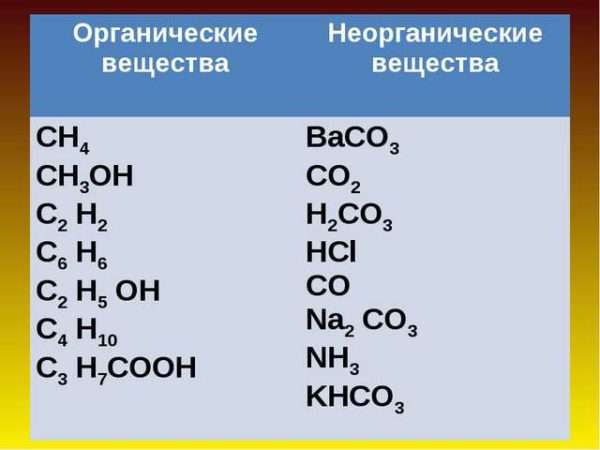
Взаимодействуя между собой, атомы элементов могут образовывать сложные молекулы химических соединений. Именно они и представляют практическую значимость для науки и промышленности. Все вещества можно разделить на два больших класса – органические и неорганические соединения. И внутри классов есть свои подклассы.
Классы неорганических соединений:
- Оксиды – бывают двух видов, кислотные и основные. Первые образованы ионом кислорода и ионом неметалла. А основные состоят из иона кислорода и иона металла.
- Кислоты – это соединения, в которых ионы водорода связаны с кислотным остатком. Пример – серная, азотная, фосфорная, кремниевая кислота. Образуется при взаимодействии оксида неметалла с водой.
- Основания – это соединение металла с гидроксид группой. Различают два типа основания – растворимые и нерастворимые в воде. Растворимые также называют щелочами. Образуются при реакции оксида металла с водой.
- Соли – это продукт взаимодействия кислот и оснований, в котором катион металла связан с анионом кислотного остатка.
 Химические соединения
Химические соединения
Классы органических соединений:
- Углеводороды – это молекулы, состоящие исключительно из ионов углерода и водорода. К ним относятся алканы, алкены, алкадиены, алкины, циклические углеводороды. Можно найти определенное сходство этого класса соединений и оксидов в неорганической химии.
- Спирты – аналогичного класса соединений в неорганике не существует. К этому классу относится всем известный этанол.
- Альдегиды – это вещества, полученные при помощи окисления спиртов.
- Кислоты – эти соединения во многом похожи на аналогичные вещества в неорганической химии, только здесь кислотный остаток органический. А получаются они окислением альдегидов.
Химия 11 класс. Основные понятия химии
Химия 11 Стехиометрические химические законы
Вывод
Это основные понятия и формулы по химии, знать которые должен каждый человек. Существует даже специальный словарь химических терминов, в котором можно найти любое определение.
