Водород простейший химический элемент во Вселенной. Его атом состоит всего из одного протона в ядре и одного электрона. Несмотря на свою физическую и химическую простоту, водород является основным элементом мироздания, благодаря ему горят и светятся звезды, наша планета покрыта водой, а сложнейшие органические соединения дали начало самому удивительному явлению во Вселенной жизни….
Особенности вещества
В природе встретить водород в составе других элементов таблицы Менделеева можно повсюду. Самым ярким примером такого соединения является такое вещество, как вода.
Водород имеет три изотопа:
- протий Н (тот самый первый элемент таблицы Менделеева, привычный нам всем водород),
- дейтерий (так называемый тяжелый водород, содержащий в ядре не только протон, но и нейтрон),
- тритий радиоактивный изотоп водорода, ядро которого состоит из протона и двух нейтронов.
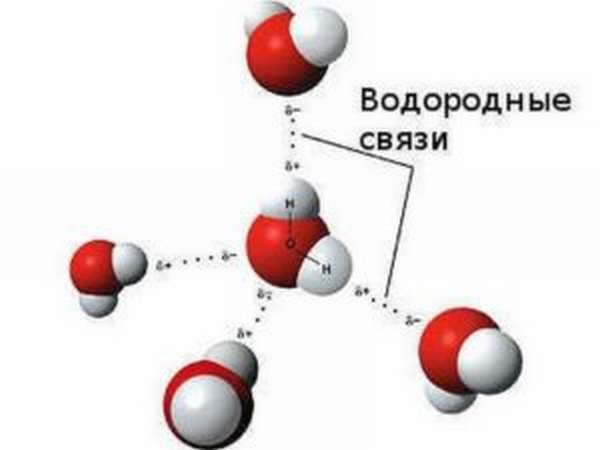
Водородная связь характерна и присутствует в большинстве органических соединений. Соединяясь с хлором, водород образует хлорную кислоту, с кислородом воду, с азотом аммиак. Данные явления, обнаруженные в конце 19 века, были открыты русскими химиками М. Ильинским и Н. Бекетовым.
Ученые установили, что содержащая водород группа атомов чаще всего образует стабильные объединения с заряженным отрицательно атомом, который может входить в состав той или ной молекулы (не исключено, что даже в ту же самую). Данная дополнительная сцепка называется водородной связью.
Природа явления
Дадим определение водородной связи (в.с.). Это взаимодействие между отрицательно заряженными частицами молекул, реализованным атомом водорода.
Если чертой обозначить связь ковалентного типа, а тремя точками водородную, то символически можно отобразить в.с. между молекулами А и В таким образом:![]() .
.
Природу данного межатомного явления понять довольно просто. Атом Н несет положительные заряды δ+, если он встречает на своем пути заряженный отрицательно и обладающий зарядом δ−, то вступает с ним в электростатический контакт.
Важно! Чаще всего в.с. заметно слабее по сравнению с ковалентными. Однако они намного крепче, чем стандартное молекулярное притяжение частиц, свойственное твердым и жидким телам.
Ковалентность
Несмотря на то, что в.с. может протекать в рамках двух частиц пары совершенно разных молекул, водородная химическая не является молекулярной связью. Свойство направления и насыщения одно из качеств в.с., которое делает ее очень похожей на ковалентную. Отметим, что во многих теориях, в.с. считается видом ковалентной связи и это совершенно никак не влияет на результаты, поэтому можно считать данное мнение корректным. Более того, сама природа в.с. очень близка к ковалентной.
Это можно легко продемонстрировать при помощи традиционных химических методов, рассчитывающих орбитали внутри молекул. В этом исчислении она будет представлять собой трехцентровые двухэлектронные связи. В очередной раз это доказывает, что отнесение ВС к разновидности ковалентной не несет ничего антинаучного.
 Водородная связь
Водородная связь
Процесс образования
Каков способ образования. Образуются водородные связи между электроотрицательными атомами, один из которых имеет свободную электронную пару.
Самым убедительным признаком в.с. является дистанция между атомом Н и вторым атомом. Все дело в том, что дистанция между атомами меньше, чем сумма двух атомарных радиусов. Не смотря на часто встречающуюся асимметрию (когда в ![]() , дистанция
, дистанция ![]() превышает расстояние
превышает расстояние ![]() ) все равно сумма радиусов атомов больше, чем расстояние между ними.
) все равно сумма радиусов атомов больше, чем расстояние между ними.
Да, асимметрия в в.с. встречается часто, однако существуют и симметричные конструкции, например HF. Угол между первым и вторым атомом в системе ![]() приближен к 180 градусам. Вспоминая фтороводороды HF, следует заметить, что соединение с фтором одно из самых крепких. HF представляет собой ион симметричного типа
приближен к 180 градусам. Вспоминая фтороводороды HF, следует заметить, что соединение с фтором одно из самых крепких. HF представляет собой ион симметричного типа ![]() . В нем энергия водородных соединений составляет порядка 150 килоджоулей в одном моле. Ковалентная связь фтороводорода приблизительно такая же. В воде Н2О в.с. значительно меньше около 20 килоджоулей на моль.
. В нем энергия водородных соединений составляет порядка 150 килоджоулей в одном моле. Ковалентная связь фтороводорода приблизительно такая же. В воде Н2О в.с. значительно меньше около 20 килоджоулей на моль.
Соединение частиц через водород найдено в большом количестве различных соединений. Химическая связь часто возникает между фтором, азотом и кислородом, так как последние являются самыми электроотрицательными элементами. Редко обнаруживается между хлором, серой и прочими элементами, не являющимися металлами.
Важно! Азот и кислород основа жизни, эти элементы содержатся в особо высокой концентрации в углеводах, белках и нуклеиновой кислоте. Если бы между этими веществами не было прочного контакта через атом Н, жизнь на Земле была бы невозможна.
Межмолекулярная водородная связь разновидность образования крепкой структуры, связывающей через атом Н одну молекулу с другой. Ярким примером является муравьиная кислота. Она представляет собой молекулу, состоящую из двух или более простых молекул (димер).
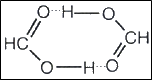
Внутримолекулярная ВС разновидность, при которой атом Н является связующим звеном в рамках одной молекулы.
То же самое относится к фтороводороду, который находится в газообразном состоянии. Он содержит такие полимерные структуры, которые могут состоять из четырех простых молекул НF, объединенных друг с другом через водород.
Примеры водородной межмолекулярной конструкции искать не приходится: растворимость глюкозы, фруктозы, сахарозы в водном растворе объясняются именно при помощи водорода и его соединительным свойствам. Молекулярные структуры живых организмов (молекула ДНК, например) содержат миллионы сложных конструкций, связанных водородом.
Функция соединений
Насколько важна социальная роль данных связей. Рассмотрим несколько веществ, которые существуют благодаря водородному соединению. Мы будем сравнивать эти молекулы с водой. Чтобы наши размышления были честными, мы будем выбирать для сравнения исключительно неметаллы. Эти вещества называются халькогеноводородами.
Например, теллур. Водородное соединение H2Te кипит при температуре -2 градуса. Что касается, селена, то H2Se кипит при температуре -42 градуса, а серный халькогеноводород H2S кипит при -60 градусах. Поразительно то, что вода кипит при +100 градусах.
Внимание! Если бы не было в.с., а кислород не обладал настолько цепкими качествами, при существующем климате на Земле не существовало бы воды в жидком состоянии. Такая высокая температура кипения непосредственное следствие водородной связи.
Сцепление атомов кислорода с водородом показано на следующем изображении.
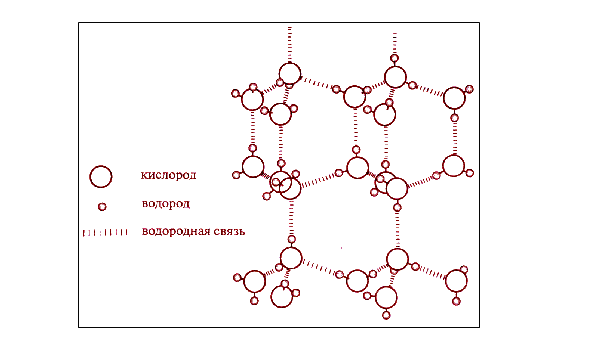 Водородная связь
Водородная связь
Но на этом удивительные свойства воды не заканчиваются. Следует также помнить о ее плавлении. И снова водородная связь именно из-за нее при плавлении плотность начинает расти. При таянии льда, каждое десятое водородное соединение разрушается, из-за чего молекулы воды приближаются друг к другу.
Типы и свойства водородной связи.
Водородная связь. Самоподготовка к ЕГЭ и ЦТ по химии
Вывод
Образования водородной связи влияют на кислотность веществ. К примеру, плавиковая кислота НF является достаточно слабой. При этом другие галогеноводородные кислоты довольно сильны. Причина этого в том, что Н соединен сразу с двумя атомами F, а это не дает им возможности отцепиться. Именно благодаря этому, НF- единственная кислота, образующая кислую соль NaHF2.
