Органические соединения с карбоксильной группой CООH часто встречаются в природе и быту. Без их производных мы не может выжить, а без всем известного уксуса не представляем себе жизни. Без них невозможно получить многих веществ, к которым мы привыкли в быту. Какие химические свойства карбоновых кислот, какие их виды существуют в природе, как их получить, где они применяются и с какими веществами реагируют, рассмотрим в этой статье.
Формула
Все они имеют кислые свойства, потому что эта группа легко отщепляет протон. Вещества содержат углеводородный радикал. По нему и называется соединение: например — CH3 – CH2 – COOH — пропановая. Формула карбоновых кислот — R – СООН, где R — это углеводородный радикал.
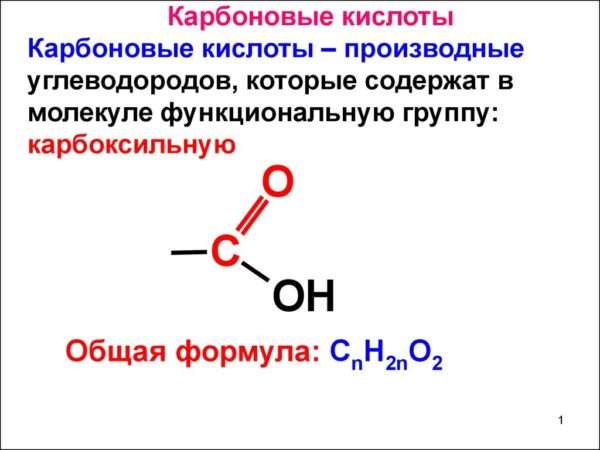 Общая формула
Общая формула
В зависимости от углеводородного радикала, который связывается с карбоксильной группой, существует такая классификация этих веществ:
- Ароматические. Они имеют ароматический радикал, простейшая из них — бензойная.
- Алифатические (все соединения, не содержащие ароматической группы), в том числе ациклические (с открытой цепью) и замкнутые. Существуют предельные карбоновые кислоты (насыщенные) и непредельные (ненасыщенные, имеющие двойные и тройные связи). К ним относят уксусную, капроновую и др.
- Алициклические содержат замкнутые кольца атомов углерода с разной степенью насыщенности.
- Гетероциклические. В них наряду с углеродом входят атомы других элементов.
Существует классификация карбоновых кислот по количеству атомов углерода: одноосновные, двухосновные и многоосновные.
Это интересно! Как самостоятельно определить валентность по таблице
Названия
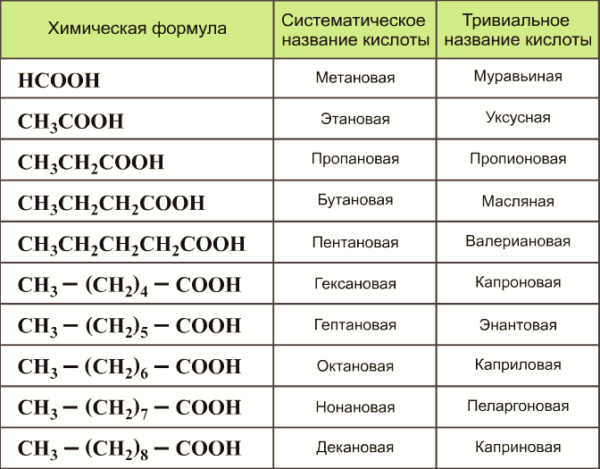
Все названия соединений с карбоксильной группой образуются по наименованию углеводорода, например:
- метановая (от углеводорода метана СН4 образовалась кислота НСООН — метановая),
- этановая — СН3COOH,
- пропановая — С2Н5COOH,
- 2-этилбутановая — CH3 – CH2 – CH – CH2 – CH3СOOH.
Но некоторые кислотные соединения имеют исторические, то есть тривиальные названия:
- муравьиная — HCOOH,
- уксусная — CH3COOH,
- пропионовая — C2H5СООН,
- масляная — С3Н7СOOH,
- капроновая — С6Н13COOH,
- стеариновая — С17Н35СOOH,
- CH2=CH CОOH — акриловая,
- СH3 — (CH2)7 — CH=CН — (CH2)7 — COOН — олеиновая,
- HООC — CООH — щавелевая.
Необходимо помнить, что такое название употребляется наряду с основным.
 Названия
Названия
Физические свойства
При знакомстве с классом карбоновые кислоты физические свойства этих веществ очень важны.
- Одноосновные кислоты имеют намного более высокую температуру плавления и кипения, чем у соответствующих углеводородов и спиртов. Так, температура плавления НСООН немногим выше 8 градусов, а кипения — более 100 градусов. Разветвленные изомеры имеют температуру плавления ниже.
- Хорошая растворимость в воде. С увеличением числа атомов углерода этот показатель снижается: так, в 100 г воды растворяется всего лишь 15 мг С9Н19СООН. Все кислотные соединения с углеродным числом более 10 практически не растворяются в воде.
- Низшие соединения являют собой подвижные легкие жидкости с резким запахом, бутановая (масляная) кислота имеет запах горького масла.
- Вещества из рассматриваемого класса с количеством атомов С от 4 до 9 — маслянистые.
- Соединения с большим количеством атомов С — твердые.
Это интересно! Что такое ковалентная связь – полярная и неполярная
Применяя карбоновые кислоты, физические свойства их нужно учитывать в работе.
 Физические свойства
Физические свойства
Химические свойства
Химические свойства карбоновых кислот такие же, что и у неорганических,
- Диссоциация в воде. Образуется ион водорода и карбоксилат ион. Наиболее сильной является метановая. Другие соединения имеют среднюю силу. Она уменьшается по мере роста атомов С.
- Реакция с металлами: 2НСООН + → ()2 + 2.
- Реакция с щелочами: → 3 + 2.
- Реакция с основным оксидом: 2НСООН +СаО → ()2 + 2.
- Реакция с солями слабых кислот: 2СН3СН + 23 → 23 + 23. В этом случае образуется натрия ацетат, а 23 выпадает в осадок.
- Реакция с аммиаком: С2Н5СООН + 3 → 254. В этом случае образуется пропионат аммония.
- Взаимодействие со спиртами: СН3СН + С2Н5ОН → СН3СС2Н5 + Н2О.
- Вступают в реакции с галогенами с синтезом хлопроизводных карбоновой кислоты и хлористого водорода. Эта реакция происходит вместе с катализатором — красного фосфора. При окислении хлором НСООН разлагается до углекислого газа и хлористого водорода.
- При воздействии чистого кислорода уксус окисляется до углекислого газа и воды.
Полезное видео: карбоновые кислоты — строение, номенклатура, изомерия
Нахождение в природе
Все рассматриваемые вещества содержатся в природе. Организмы живых существ постоянно контактируют с кислотными соединениями..
Предельные карбоновые кислоты можно обнаружить в таком виде:
- Муравьиная находится в крапиве, яде пчел, выделениях муравья.
- Уксусная образуется во время уксусно-кислого брожения.
- Валериановая находится в корнях валерианы.
- Капроновая содержится в молоке коз.
- Миристиновая содержится в приятно пахнущих частях мускатного ореха.
- Пальмитиновая в значительном количестве содержится в пальмовом масле.
- Стеариновая — основа свиного сала. Относится к очень важным жирным кислотным соединениям.
- Церотиновая имеет большое количество атомов С и есть в восках.
Интересно! Кислый вкус испортившегося вина объясняется как раз наличием в нем уксуса. А неприятный запах испорченного масла объясняется тем, что в нем в большом количестве находится неприятно пахнущая С3Н7СООН.
В природе также распространены и двухосновные карбоновые кислотные соединения:
- Кислый вкус щавеля и ревеня объясняется нахождением в нем щавлевой кислоты. Она образуется при разложении некоторых аминокислот. В человеческом организме при некоторых обменных заболеваниях может образовываться нерастворимая кальциевая соль этого вещества.
- При прокаливании янтаря образуется янтарная кислота.
- Малоновая содержится в яблоках.
- Глутаровая содержится в клейковине злаковых. Отсюда она получила свое название.
Это интересно! Что такое алканы: строение и химические свойства
Названий очень много, и по мере развития науки их количество увеличивается.
Интересно! Гидроксикислоты синтезируются при молочнокислом сбраживании углеводов. Привычное всем скисание молока с образованием простокваши и кефира — это не что иное, как естественный синтез молочной кислоты. Тот же процесс происходит при естественном брожении вина или пива.
 Нахождение в природе
Нахождение в природе
Как получить
Получение рассматриваемых веществ в промышленности имеет много способов.
Рассмотрим некоторые их них:
- Выделение из природных материалов — жиров, масел и восков.
- Окисление насыщенных углеводородов. Происходит при повышенной температуре, например: 2СН4 + 3О2 → 2 + 22.
- Окисление углеводородов с двойной связью, например = + О2 — СН3СОО.
- Бензойную можно получить таким путем: 565-CH3 + 6КМnO4 + 9H2SO4 → 5C6H5 + 3К2SO4 + 6МnSO4 + 14H2O.
- Муравьиную можно синтезировать с помощью таких реакций: CO + NаOH → НCOON и HCООNа + H2SO4 → HCOOH + .
Это интересно! Уроки химии: что это такое галогены
В условиях лаборатории рассматриваемые соединения можно получить с помощью таких реакций:
- Применение солей: R – COONa + HCl → R – COOH + NaCl.
- Растворение соответствующих ангидридов в воде: (R – CO)2O + H2O → 2 R – COOH. Так можно получить, например, карбоновую кислоту С2Н5ССОН.
- Окисление альдегидов: R – COH + [O] → R – COOH.
- Окисление спиртов: R – CH2 – OH + 2[O] → R – COOH + H2O.
- С применением цианида: СH3 – Вr + Na – C≡N → CH3 – CN + NaВr .
Во всех случаях символ R означает любой углеводородный радикал.
 Химические свойства карбоновых кислот
Химические свойства карбоновых кислот
Применение органических соединений
Применение карбоновых кислот широко распространено в промышленности и быту. Так, НСООН обладает выраженными антибактериальными свойствами. Применяется для изготовления клеев, лаков, красителей. Сложные эфиры вещества — это растворители для пахнущих веществ. Бездепозитный бонус https://3bezdepobonus.com совершенно бесплатно
Интересно! НСООН применяется в пищевой промышленности как пищевая добавка с кодом Е236. Добавка содержится как консервант в кондитерских и консервированных, некоторых молочных продуктах. Без нее невозможно нормально продезинфицировать пивные и винные бочки.
Известный всем муравьиный спирт применяется в медицине в качестве противовоспалительного, болеутоляющего средства. Рефлекторно действует как раздражитель. НСООН используется для повышения срока хранения сена, силоса, потому что это вещество замедляет процесс гниения и распада органических веществ.
Уксус находит широкое применение не только как добавка к пище и для приготовления консервов. С ее помощью можно легко синтезировать лаки, красители для тканей. Огромные количества СН3СООН расходуются для выработки широко используемого ацетатного волокна, пластмассы, кинопленки, устойчивой к воспламенению и возгоранию, ядов, органического стекла. Ацетаты широко используются в сельском хозяйстве как эффективные ядохимикаты.
Это интересно! Для чего делают и что это такое гидролиз солей
Несмотря на отвратительный запах прогорклого масла, С3Н7СООН используется для терапии патологий пищеварительного тракта. Она регулирует кишечную перистальтику, способствует развитию полезных бактерий. Сложные эфиры этого вещества имеют приятный запах, а поэтому они применяются в качестве основы для парфюмерной композиции.
Стеарин и пальмитин используют в процессе реакций с глицерином и образует мыло. Косметические вещества быстро впитываются и не вызывают аллергии. В химии применяют одноосновные карбоновые кислоты с более высоким углеродным числом.
Щавелевая применяется почти во всех отраслях промышленности благодаря ее уникальным свойствам.
Полезное видео: карбоновые кислоты и их соли
Вывод
Вещества с карбоксильной группой широко распространены в природе. Благодаря своим свойствам они широко применяются в быту и в промышленности. Количество этих соединение все время возрастает по мере развития химической науки.
