Вода — самый распространенный на земле растворитель. Особенно хорошо в ней растворяются вещества ионного строения, такие как соли. При попадании в воду растворимые соли диссоциируют — разделяются на ионы. Но некоторые вещества не просто растворяются, а разлагаются водой. При этом возникают новые вещества. Такой процесс называется гидролизом. Что такое гидролиз?
Определение
Реакция между растворителем и растворяемым веществом, при которой они оба разделяются на составные части, а продуктами становятся новые вещества, называется сольволизом. Гидролиз в химии — это частный случай такой реакции, где в роли растворителя выступает вода.
 Что такое гидролиз
Что такое гидролиз
Различают разложение:
- по аниону,
- по катиону,
- по аниону и катиону,
- щелочное,
- кислотное,
- ферментативное.
Википедия приводит такое определение гидролиза. Это взаимодействие с водой, в ходе которого вещество разлагается на составные части, и получаются новые соединения. Такие реакции значительно отличаются у органических и неорганических веществ, солей, протеинов, липидов и прочих.
 Что такое гидролиз
Что такое гидролиз
В общем виде уравнение выглядит так:
MA+H2O⇄HA+MOH,
где MA — соль, HA — кислота, MOH — основание.
Что такое гидролиз солей? Это реакция обмена ионами между Н2О и растворимой солью. Если результат такого взаимодействия соединения, которые плохо диссоциируют, то продуктами такого превращения будут слабые электролиты. Гидролиз как реакция — процесс, противоположный нейтрализации. В отличие от нее он эндотермический. Он может идти обратимо и необратимо.
Какой процесс называется необратимым гидролизом? Реакция гидролиза необратима, если продукт реакции выводится из раствора, то есть осаждается или улетучивается в виде газа, а также если получается и газ, и осадок.
Это интересно! Как отличить металлы и неметаллы в таблице элементов Менделеева
Виды
То, как пойдет процесс, зависит от свойств основания и кислоты, образовавших конкретное соединение.
Обратите внимание! Соль сильной кислоты и сильного основания не гидролизуется, раствор будет с нейтральным pH.
 Константа гидролиза
Константа гидролиза
Виды гидролиза:
- По катиону и аниону. Соединение слабого основания и слабой кислоты, органическое или неорганическое, разлагается и по положительному, и по отрицательному иону. Получившийся раствор может иметь слабощелочную, слабокислую или нейтральную среду.
- По катиону. Разложение неорганических солей слабого основания и сильной кислоты проходит по катиону. Он соединяется с гидроксильным ионом ОН. Оставшиеся положительно заряженные частицы Н делают раствор кислотным. Так гидролизуется, например, сернокислая медь CuSO4.
- По аниону. Способность гидролизоваться по отрицательному иону свойственна солям сильных оснований и слабых кислот. Отрицательный ион кислотного остатка объединяется с частицей Н+ из Н2О, остается избыточное количество гидроксид-ионов. Поэтому pH в полученном растворе станет щелочным. Пример — KNO2. Если он прореагирует с Н2О, получится гидроксид калия KOH и азотистая кислота HNO2.
- Щелочной. Этот тип процесса характерен для органических соединений. Они гидролизуются в присутствии щелочи. Например, в присутствии NaOH гидролизуется C5H11Cl.
- Кислотный. Процесс в присутствии сильных неорганических кислот (серной, соляной) характерен только для органических соединений, таких как сложные эфиры.
- Ферментативный. Ферменты (энзимы) выступают катализаторами для расщепления биополимеров: белков, жиров, липоидов, крахмалов, гликогена и других. Именно такие процессы проходят в пищеварительном тракте.
- Ступенчатый гидролиз. Разложение в несколько стадий происходит, когда с H2O реагирует соль многоосновной кислоты или многокислотного основания. Сначала проходит разложение исходное соединение, возникает новая соль, она затем также гидролизуется. Таких ступеней может быть несколько. Na2CO3 — результат взаимодействия сильного основания и слабой кислоты. На первой стадии она разлагается по аниону, и получается NaHCO3. Далее идет ее сольволиз в водном растворе, получается слабая кислота H2CO3.
Полезное видео: гидролиз солей
Формула
Как делать эту реакцию? Для этого соль нужно поместить в воду, но они могут и не начать реагировать друг с другом. Реакция пойдет при наличии ионов слабого основания или слабой кислоты.
Как записать уравнение реакции? Формула записывается по следующему алгоритму.
- Сначала пишут уравнение диссоциации. Это нужно, чтобы увидеть, из каких ионов состоит соединение, и определить тип процесса.
- Далее пишут полное ионное уравнение. В нем указывают заряд частиц.
- Далее отбрасывают одинаковые ионы справа и слева, получая сокращенное ионное уравнение. При этом можно узнать среду раствора. Если остался ион Н+, она кислая, если ОН- щелочная.
- Затем записывают молекулярное уравнение. В нем «собирают» из заряженных частиц нейтральные. Чтобы уравнять число частиц справа и слева, подставляют нужные коэффициенты. Вместо знака равно” везде пишут стрелки вправо и влево. Это значит, что процесс может идти и в одну, и в другую сторону.
Пример — уксуснокислый калий CH3COOK.
Уравнение диссоциации: CH3COOK⇄ CH3COO- + K+
Это соединение состоит из положительного иона сильной щелочи КОН и отрицательного слабой СН3СООН. Реакция гидролиза идет по аниону.
Полное ионное уравнение:
CH3COO- + К+ +НОН ⇄CH3COOН + К+ +ОН-
Остался гидроксид-ион, значит pH щелочной.
Отбрасываем катионы калия с обеих сторон:
CH3COO- +НОН⇄СН3СООН +ОН-
Молекулярное уравнение:
CH3COOK+H2O ⇄ CH3COOН+KOH.
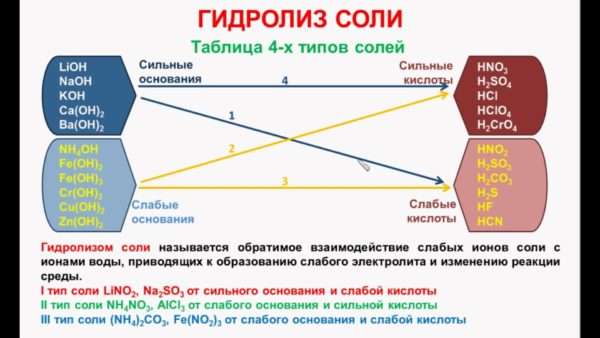 Таблица 4-х типов солей
Таблица 4-х типов солей
Степень гидролиза
Важно! Степень гидролиза — это его количественная характеристика. Это отношение количества гидролизовавшегося соединения к его общему количеству в процентах. Ее обозначают греческой буквой альфа или h_гидр.
От чего зависит эта величина?
- Чем более слабая кислота или основание, при взаимодействии которых получилась соль, тем больше h_гидр.
- Температура раствора. Чем он холоднее, тем меньше вещество способно гидролизоваться.
- Концентрация раствора. Если сильнее развести раствор водой, степень повышается — по принципу Ле-Шателье, идет сдвиг равновесия к продуктам.
- Наличие катализаторов. Это особенно характерно для органики.
Это интересно! Уроки химии: что это такое галогены
У соединения сильной кислоты и основания степень нулевая (разложения не происходит), а у слабых эта величина велика (почти вся соль гидролизуется).
Еще одна характеристика такого процесса разложения— константа гидролиза К_g. Это константа равновесия для гидролиза. Она показывает, насколько вещество склонно гидролизоваться.
Константу можно выразить через степень:
К_g = h_гидр2*С/(1-h_гидр)
Обычно h_гидр — очень маленькое число, поэтому соотношение можно упростить: К_g = h_гидр2*С. Это соотношение справедливо для неорганических солей.
 Константа гидролиза
Константа гидролиза
Практическое применение и значение
Реакции разложения водой распространены в природе, а человек нашел им применение в быту и в производстве:
- Они применяются для очищения воды от железа способом аэрации. Сквозь воду пропускают кислород, который окисляет растворенный в ней Fe(HCO3)2 до соли железа (III). Такая соль гидролизуется практически полностью. При этом выпадают в осадок нерастворимые кристаллы Fe(OH)3.
- Применяют этот процесс для удаления и других примесей из воды. Для этого добавляют соли алюминия. Если присутствуют гидрокарбонат-ионы, происходит их полное разложение, получается полигидрат оксида железа, который коагулирует и осаждается, собирая на себя примеси.
- Ферментативное разложение органических веществ происходит при пищеварении. Расщепление водой в присутствии ферментов используют также для производства пищевых продуктов, лечебного питания, лекарств. Например, белковые гидролизаты применяют для парентерального (внутривенного) питания больных.
- Разложение водой органических веществ имеет значение в химии, а именно в химической промышленности. Из крахмала получается глюкоза и патока, а при разложении водой целлюлозы — этанол. Разлагая водой торф, получают кормовые дрожжи, воск, удобрения.
- На этом процессе основана работа моющих средств. Мыло, например, распадается на ионы Na и углеводородный остаток. В жесткой воде сложно получить хорошую мыльную пену. В такой воде, где много ионов кальция и магния, они вступают во взаимодействие с углеводородным остатком, образуя плохо растворимые соединения.
- С помощью такой реакции можно обнаружить присутствие ионов висмута, сурьмы, бериллия.
Это интересно! Что такое ковалентная связь – полярная и неполярная
Полезное видео: гидролиз солей — классификация солей
Заключение
Гидролиз — это разложение веществ водой с образованием новых соединений. Реакции такого типа многообразны и сильно отличаются для разных классов веществ. Многие из них используются в быту и промышленности. Разложение водой органических веществ происходит при пищеварении. Основные характеристики этого процесса — это его степень и константа.
