Долгое время одно из соединений этого элемента, а именно его двуокись (известна под названием пиролюзит) считалось разновидностью минерала магнитный железняк. Лишь в 1774 году один из шведских химиков выяснил, что в пиролюзите есть неизученный металл. В результате нагревания этого минерала с углем удалось получить тот самый неизвестный металл. Вначале его называли манганум, позже появилось современное название — марганец. Химический элемент обладает многими интересными свойствами, речь о которых пойдет далее.
Марганец как химический элемент
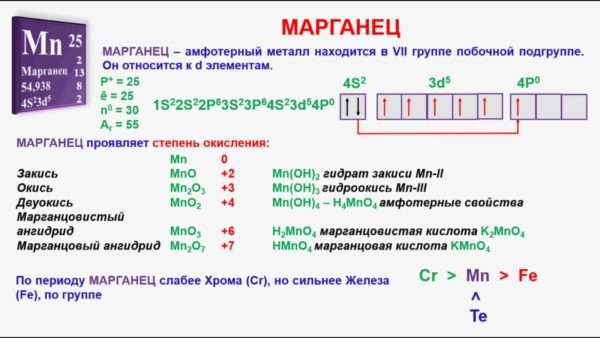
Расположен в побочной подгруппе седьмой группы периодической таблицы (важно: все элементы побочных подгрупп — металлы). Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (типичная формула d-элемента). Марганец как свободное вещество имеет серебристо-белый цвет. Из-за химической активности в природе встречается лишь в виде соединений, таких как окислы, фосфат и карбонат. Вещество тугоплавкое, температура плавления составляет 1244 градуса по шкале Цельсия.
Интересно! В природе встречается только один изотоп химического элемента, имеющий атомную массу 55. Остальные изотопы получены искусственным путем, и наиболее устойчив радиоактивный изотоп с атомной массой 53 (период полураспада примерно такой же, как у урана).
 Марганец
Марганец
Степень окисления марганца
У него шесть разных степеней окисления. В нулевой степени окисления элемент способен образовывать комплексные соединения с органическими лигандами (например, P(C5H5)3), а также неорганическими лигандами:
- окисью углерода (декакарбонил димарганца),
- азотом,
- трифторидом фосфора,
- окисью азота.
Степень окисления +2 типична для солей марганца. Важно: у этих соединений сугубо восстановительные свойства. Наиболее устойчивые соединения, имеющие степень окисления +3, — оксид Mn2O3, а также гидрат этого оксида Mn(OH)3. В степени окисления +4 наиболее устойчивы MnO2 и амфотерный оксид-гидроксид MnO(OH)2.
Степень окисления марганца +6 типична для существующей только в водном растворе марганцеватой кислоты и ее солей. Степень окисления +7 типична для существующей только в водном растворе марганцевой кислоты, ее ангидрида, а также солей — перманганатов (аналогия с перхлоратами) — сильных окислителей. Интересно, что при восстановлении перманганата калия (в быту называется марганцовкой) возможны три разные реакции:
- В присутствии серной кислоты анион MnO4- восстанавливается до Mn2+.
- Если среда нейтральная, ион MnO4- восстанавливается до MnO(OH)2 или MnO2.
- В присутствии щелочи анион MnO4- восстанавливается до манганат-иона MnO42-.
 Марганец как химический элемент
Марганец как химический элемент
Химические свойства
В обычных условиях малоактивен. Причина — появляющаяся при воздействии кислорода воздуха оксидная пленка. Если же порошок металла слегка нагреть, он сгорает, превращаясь в MnO2.
При нагревании взаимодействует с водой, вытесняя водород. В результате реакции получается практически нерастворимый гидрат закиси Mn(OH)2. Это вещество препятствует дальнейшему взаимодействию с водой.
Интересно! Водород растворим в марганце, и при повышении температуры растворимость увеличивается (получается раствор газа в металле).
При очень сильном нагревании (температура выше 1200 градусов по шкале Цельсия) взаимодействует с азотом, при этом получаются нитриды. Эти соединения могут иметь различный состав, что типично для так называемых бертоллидов. Взаимодействует с бором, фосфором, кремнием, а в расплавленном виде — с углеродом. Последняя реакция протекает при восстановлении марганца коксом.
При взаимодействии с разбавленной серной и соляной кислотами получается соль и выделяется водород. А вот взаимодействие с крепкой серной кислотой иное: продукты реакции — соль, вода и двуокись серы (вначале серная кислота восстанавливается в сернистую, но из-за неустойчивости сернистая кислота распадается на диоксид серы и воду).
Это интересно! Что такое алканы: строение и химические свойства
При реакции с разбавленной азотной кислотой получается нитрат, вода, окись азота.
Образует шесть оксидов:
- закись, или MnO,
- окись, или Mn2O3,
- закись-окись Mn3O4,
- двуокись, или MnO2,
- марганцеватый ангидрид MnO3,
- марганцевый ангидрид Mn2O7.
Интересно! Закись под воздействием кислорода воздуха постепенно превращается в окись. Ангидрид марганцеватой кислоты не выделен в свободном виде.
Закись-окись — соединение с так называемой дробной степенью окисления. При растворении в кислотах образуются соли двухвалентного марганца (соли с катионом Mn3+ неустойчивы и восстанавливаются до соединений с катионом Mn2+).
Двуокись, окись, закись-окись — наиболее устойчивые оксиды. Марганцевый ангидрид неустойчив. Прослеживаются аналогии с другими химическими элементами:
- Mn2O3 и Mn3O4 — основные оксиды, и по свойствам похожи на аналогичные соединения железа,
- MnO2 — амфотерный оксид, по свойствам похож на оксиды алюминия и трехвалентного хрома,
- Mn2O7 — кислотный оксид, по свойствам весьма похож на высший оксид хлора.
Несложно заметить и аналогию с хлоратами и перхлоратами. Манганаты, подобно хлоратам, получаются косвенным путем. А вот перманганаты можно получить как прямым путем, то есть при взаимодействии ангидрида и оксида/гидроксида металла в присутствии воды, так и косвенным.
В аналитической химии катион Mn2+ попал в пятую аналитическую группу. Есть несколько реакций, позволяющих обнаружить этот катион:
- При взаимодействии с сульфидом аммония выпадает осадок MnS, его цвет — телесный, при добавлении минеральных кислот наблюдается растворение осадка.
- При реакции с щелочами получается белый осадок Mn(OH)2, однако при взаимодействии с кислородом воздуха цвет осадка меняется с белого на бурый — получается Mn(OH)3.
- Если к солям с катионом Mn2+ добавить перекись водорода и раствор щелочи, выпадает темно-бурый осадок MnO(OH)2.
- При добавлении к солям с катионом Mn2+ окислителя (двуокись свинца, висмутат натрия) и крепкий раствор азотной кислоты, раствор окрашивается в малиновый цвет — это значит, что Mn2+ окислился до HMnO4.
 Химические свойства
Химические свойства
Валентности марганца
Элемент находится в седьмой группе. Типичные валентности марганца – II, III, IV, VI, VII.
Нулевая валентность типична для свободного вещества. Двухвалентные соединения — соли с катионом Mn2+, трехвалентные – оксид и гидроксид, четырехвалентные – двуокись, а также оксид-гидроксид. Шести- и семивалентные соединения — соли с анионами MnO42- и MnO4-.
Как получить и из чего получают марганец? Из марганцевых и железо-марганцевых руд, а также из растворов солей. Известно три разных способа получения марганца:
- восстановление коксом,
- алюмотермия,
- электролиз.
В первом случае в качестве восстановителя используется кокс, а также окись углерода. Восстанавливается металл из руды, где есть примесь оксидов железа. В результате получается как ферромарганец (сплав с железом), так и карбид (что такое карбид? это соединение металла с углеродом).
Для получения более чистого вещества используется один из способов металлотермии — алюмотермия. Сначала прокаливается пиролюзит, при этом получается Mn2O3. Затем полученный оксид смешивают с порошком алюминия. В ходе реакции выделяется много теплоты, в результате получающийся металл плавится, а оксид алюминия покрывает его шлаковой «шапкой».
Марганец — металл средней активности и стоит в ряду Бекетова левее водорода и правее алюминия. Это значит, что при электролизе водных растворов солей с катионом Mn2+ на катоде восстанавливается катион металла (при электролизе весьма разбавленного раствора на катоде восстанавливается и вода). При электролизе водного раствора MnCl2 протекают реакции:
MnCl2 Mn2+ + 2Cl-
Катод (отрицательно заряженный электрод): Mn2+ + 2e Mn0
Анод (положительно заряженный электрод): 2Cl- 2e 2Cl0 Cl2
Итоговое уравнение реакции:
MnCl2 (эл-з) Mn + Cl2
При электролизе получается наиболее чистый металлический марганец.
Полезное видео: марганец и его соединения
Применение
Применение марганца довольно широко. Используется как сам металл, так и его различные соединения. В свободном виде используется в металлургии для разных целей:
- как «раскислитель» при плавке стали (связывается кислород, и образуется Mn2O3),
- в качестве легирующего элемента: получается прочная сталь с высокими показателями износостойкости и ударопрочности,
- для выплавки так называемой броневой марки стали,
- как компонент бронзы и латуни,
- для создания манганина, сплава с медью и никелем. Из этого сплава делают различные электротехнические устройства, например реостаты
Для изготовления гальванических элементов Zn-Mn используется MnO2. В электротехнике применяются MnTe и MnAs.
Это интересно! Уроки химии: что это такое галогены
 Применение марганца
Применение марганца
Интересные факты
Перманганат калия, часто называемый марганцовкой, широко применяется как в быту (для лечебных ванночек), так и в промышленности и лабораториях. Малиновая окраска перманганата обесцвечивается при пропускании через раствор ненасыщенных углеводородов с двойными и тройными связями. При сильном нагревании перманганаты разлагаются. При этом получаются манганаты, MnO2, а также кислород. Это один из способов получить химически чистый кислород в лабораторных условиях.
Получить соли марганцеватой кислоты можно лишь косвенным путем. Для этого MnO2 смешивают с твердой щелочью и в присутствии кислорода нагревают. Другой способ получения твердых манганатов – прокаливание перманганатов.
Растворы манганатов имеют красивую темно-зеленую окраску. Однако эти растворы неустойчивы и подвергаются реакции диспропорционирования: темно-зеленая окраска меняется на малиновую, также выпадает бурый осадок. В результате реакции получается перманганат и MnO2.
Это интересно! Для чего делают и что это такое гидролиз солей
Диоксид марганца применяется в лаборатории как катализатор при разложении хлората калия (бертолетовой соли), а также для получения чистого хлора. Интересно, что в результате взаимодействия MnO2 с хлороводородом получается промежуточный продукт – крайне неустойчивое соединение MnCl4, распадающееся на MnCl2 и хлор. Нейтральные или подкисленные растворы солей с катионом Mn2+ имеют бледно-розовую окраску (Mn2+ создает комплекс с 6 молекулами воды).
Полезное видео: марганец элемент жизни
Вывод
Такова краткая характеристика марганца и его химические свойства. Это серебристо-белый металл средней активности, взаимодействует с водой лишь при нагревании, в зависимости от степени окисления проявляет как металлические, так и неметаллические свойства. Его соединения используются в промышленности, в быту и в лабораториях для получения чистого кислорода и хлора.
