 Одним из первых типов химических соединений, изучаемых в школьной программе по органической химии, являются алканы. Они относятся к группе предельных (иначе — алифатических) углеводородов. В их молекулах присутствуют только одинарные связи. Атомам углерода свойственна sp³-гибридизация.
Одним из первых типов химических соединений, изучаемых в школьной программе по органической химии, являются алканы. Они относятся к группе предельных (иначе — алифатических) углеводородов. В их молекулах присутствуют только одинарные связи. Атомам углерода свойственна sp³-гибридизация.
Гомологический ряд метана
 Гомологами называют химические вещества, которые имеют общие свойства и химическое строение, но при этом отличающиеся на одну или несколько CH2-групп.
Гомологами называют химические вещества, которые имеют общие свойства и химическое строение, но при этом отличающиеся на одну или несколько CH2-групп.
В случае с метаном CH4 можно привести общую формулу для алканов: CnH (2n+2), где n — это количество атомов углерода в соединении.
Приведём таблицу алканов, в которых n находится в пределах от 1 до 10.
Изомерия алканов
Изомерами называют те вещества, молекулярная формула которых совпадает, однако строение или структура отличается.
Для класса алканов характерны 2 типа изомерии: углеродного скелета и оптическая изомерия.
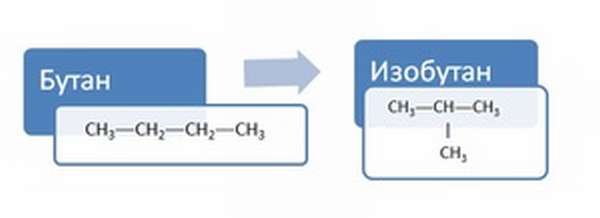
Приведём пример структурного изомера (т. е. вещества, отличающимся лишь строением углеродного скелета) для бутана C4H10.
Оптическими изомерами называют такие 2 вещества, молекулы которых имеют похожую структуру, но не могут быть совмещены в пространстве. Явление оптической или зеркальной изомерии возникает у алканов, начиная с гептана C7H16.
Номенклатура веществ
Чтобы дать алкану правильное название, необходимо воспользоваться номенклатурой ИЮПАК. Для этого использоваться следующая последовательность действий:
 Выбрать самую длинную неразветвленную цепь из атомов углерода.
Выбрать самую длинную неразветвленную цепь из атомов углерода.- Пронумеровать атомы в цепи. Нумерацию необходимо начинать с той стороны, к которой ближе находится заместитель (ответвление).
- Сформировать и записать название вещества. В его начале цифрами нужно указать, при каких атомах находятся заместители. После номера указывается их количество («ди» — 2 заместителя, «три» — 3, «тетра» — 4), затем через дефис — их названия, перечислять которые нужно в алфавитном порядке. После этого указывается наименование главной цепи. Названия заместителей формируются при помощи суффикса -ил: так, заместитель -CH3 получит название метил, а -CH2-CH2-CH3 — пропил. Главная цепь именуется так же, как и алкан с соответствующим количеством углеродных атомов.
По приведённому выше плану попробуем дать название следующему алкану.
 Нужно выбрать самую длинную цепь. Очевидно, что ей является последовательность из 7 атомов углерода.
Нужно выбрать самую длинную цепь. Очевидно, что ей является последовательность из 7 атомов углерода.- Следует определить, с какой стороны пойдёт нумерация. В конкретном случае она начнётся с того конца, ближе к которому находится ответвление, т. е. с левого края.
- В приведённой молекуле есть 4 заместителя с 1 атомом углерода (при 2, 4 и дважды при 5 атомах) и 1 заместитель с 2 атомами (при 4 атоме в главной цепи). Основная цепь состоит из 7 атомов, её название — гептан. Сформулированное для вещества имеет название: 2,3,5,5-тетраметил-4-этилгептан.
Физические свойства алканов
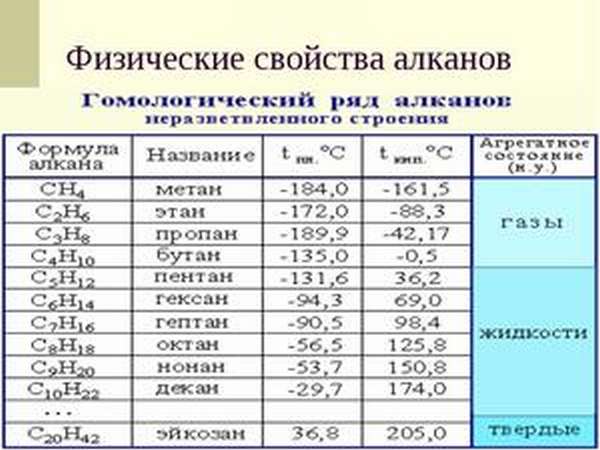 В обычных условиях неразветвленные алканы с CH4 до C4H10 — это газообразные вещества, начиная с С5Н12 и до C13H28 — жидкие и обладающие специфическим запахом, все последующие — твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
В обычных условиях неразветвленные алканы с CH4 до C4H10 — это газообразные вещества, начиная с С5Н12 и до C13H28 — жидкие и обладающие специфическим запахом, все последующие — твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
Газообразные алканы не обладают цветом. А также все представители этого класса не могут растворяться в воде.
Алканы, имеющие агрегатное состояние газа, могут гореть, при этом пламя будет либо бесцветным, либо обладать бледно-голубым оттенком.
Химические свойства
В обычных условиях алканы достаточно малоактивны. Это объясняется прочностью σ-связей между атомами C-C и C-H. Поэтому необходимо обеспечить специальные условия (например, довольно высокую температуру или свет), чтобы проведение химической реакции стало возможным.
Реакции замещения
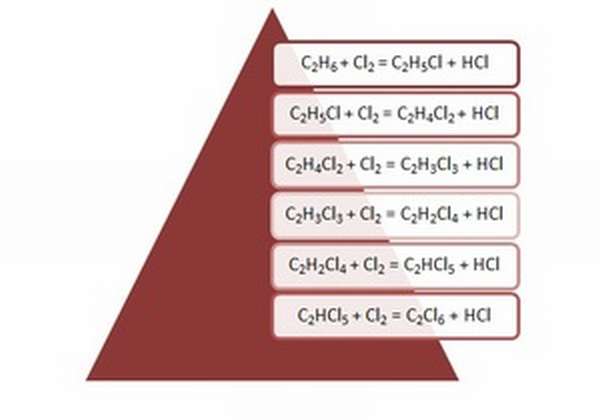
К реакциям этого типа относятся галогенирование и нитрование. Галогенирование (взаимодействие с Cl2 или Br2) происходит при нагревании или же под воздействием света. Во время реакции, протекающей последовательно, образуются галогеналканы.
Для примера можно записать реакцию хлорирования этана.
Бромирование будет проходить аналогичным образом.
Нитрование — это реакция со слабым (10%) раствором HNO3 или с оксидом азота (IV) NO2. Условия для проведения реакций — температура 140 °C и давление.
C3H8 + HNO3 = C3H7NO2 + H2O.
В результате образуются два продукта — вода и аминокислота.
Реакции разложения
При проведении реакций разложения всегда требуется обеспечивать высокую температуру. Это необходимо для разрыва связей между атомами углерода и водорода.
Так, при проведении крекинга потребуется температура в интервале от 700 до 1000 °C. Во время реакции разрушаются -С-С- связи, образуется новый алкан и алкен:
C8H18 = C4H10 + C4H8
Исключение — крекинг метана и этана. В результате этих реакций выделяется водород и образуется алкин ацетилен. Обязательным условием является нагревание до 1500 °C.
C2H4 = C2H2 + H2
Если превысить температуру в 1000 °C, можно добиться пиролиза с полным разрывом связей в соединении:
C3H8 = 3C + 4H2
Во время пиролиза пропила был получен углерод C, а также выделился водород H2.
Реакции дегидрирования
Дегидрирование (отщепление водорода) происходит по-разному для различных алканов. Условия проведения реакции — температура в пределах от 400 до 600 °C, а также присутствие катализатора, в роли которого могут выступать никель или платина.
Из соединения, в углеродном скелете которого 2 или 3 атома C, образуется алкен:
C2H6 = C2H4 + H2.
Если в цепи молекулы 4—5 атомов углерода, то после дегидрирования получится алкадиен и водород.
C5H12 = C4H8 + 2H2.
Начиная с гексана, во время реакции образуется бензол или производные от него вещества.
C6H14 = C6H6 + 4H2
Следует также упомянуть реакцию конверсии, проводящуюся для метана при температуре 800 °C и в присутствии никеля:
CH4 + H2O = CO + 3H2
Для других алканов конверсия нехарактерна.
Окисление и горение
Если алкан, нагретый до температуры не более 200 °C, будет взаимодействовать с кислородом в присутствии катализатора, то в зависимости от прочих условий проведения реакции будут различаться получаемые продукты: это могут быть представители классов альдегидов, карбоновых кислот, спиртов или кетонов.
В случае полного окисления алкан сгорает до конечных продуктов — воды и CO2:
C9H20 + 14O2 = 9CO2 + 10H2O
Если во время окисления количество кислорода оказалось недостаточным, конечным продуктом вместо углекислого газа станет уголь или CO.
Проведение изомеризации
Если обеспечить температуру около 100—200 градусов, для неразветвленных алканов становится возможна реакция перегруппировки. онлайн, необходимо подать соответствующий запрос в компанию или организацию, которая регулирует деятельность интернет казино. Данные организации проверят онлайн казино на соответствие всем требованием и если все организовано верно, площадка сможет получить разрешение. Казино и выбрать требуемый метод. Затем нужно скопировать кошелек и перевести на него желаемую сумму пополнения из крипто-биржи. Средства на баланс зачисляются практически моментально. Второе обязательное условие для проведения изомеризации — присутствие катализатора AlCl3. В таком случае происходит изменение структуры молекул вещества и образуется его изомер.
Получение и применение алканов
 Значительную долю алканов получают, выделяя их из природного сырья. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
Значительную долю алканов получают, выделяя их из природного сырья. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
А также следует вспомнить о химических свойствах алкенов. В 10 классе одним из первых лабораторных способов, изучаемых на уроках химии, является гидрирование непредельных углеводородов.
C3H6 + H2 = C3H8
Например, в результате присоединения водорода к пропилену получается единственный продукт — пропан.
При помощи реакции Вюрца из моногалогеналканов получают алканы, в структурной цепи которых число углеродных атомов удвоено:
2CH4H9Br + 2Na = C8H18 + 2NaBr.
Ещё один способ получения — взаимодействие соли карбоновой кислоты со щёлочью при нагревании:
C2H5COONa + NaOH = Na2CO3 + C2H6.
Кроме того, метан иногда получают в электрической дуге (C + 2H2 = CH4) или при взаимодействии карбида алюминия с водой:
Al4C3 + 12H2O = 3CH4 + 4Al (OH)3.
Алканы широко применяются в промышленности в качестве низкого по стоимости топлива. А также их используют как сырьё для синтеза других органических веществ. С этой целью обычно применяют метан, необходимый для получения аммиака и синтез-газа. Некоторые другие предельные углеводороды используют, чтобы получать синтетические жиры, а также как основу для смазочных материалов.
Для наилучшего понимания темы «Алканы» создан не один видеоурок, в котором подробно рассмотрены такие темы, как структура вещества, изомеры и номенклатура, а также показаны механизмы химических реакций.
